O que são os inibidores de tirosina-quinase (TKIs) e por que são usados no câncer renal?
O tratamento do câncer renal avançou significativamente nas últimas décadas, e os inibidores de tirosina-quinase (TKIs) se tornaram parte essencial desse progresso. Utilizados principalmente no carcinoma de células renais metastático, esses medicamentos atuam bloqueando mecanismos moleculares que alimentam o crescimento do tumor.
Neste artigo, você vai entender o que são os TKIs, como funcionam e por que são indicados no câncer renal.
Continue a leitura e descubra as principais informações sobre o tema.
O que são os inibidores de tirosina-quinase?
Os inibidores de tirosina-quinase (ou TKIs) são medicamentos orais
usados para
interromper sinais moleculares que estimulam o crescimento de alguns tipos de câncer. Essas substâncias atuam
bloqueando enzimas
chamadas tirosina-quinases, que funcionam como “gatilhos” bioquímicos responsáveis por ativar processos celulares como multiplicação descontrolada, formação de novos vasos sanguíneos (angiogênese) e resistência à morte celular — mecanismos frequentemente presentes em tumores malignos.
Como atuam no organismo:
- Interrompem o funcionamento de receptores celulares ligados à proliferação tumoral.
- Impedem o desenvolvimento de vasos sanguíneos que alimentam o tumor.
- Dificultam a progressão e a disseminação da doença.
Esse bloqueio contribui para
controlar o crescimento do câncer e é particularmente útil em casos nos quais outras abordagens não surtiram efeito satisfatório.
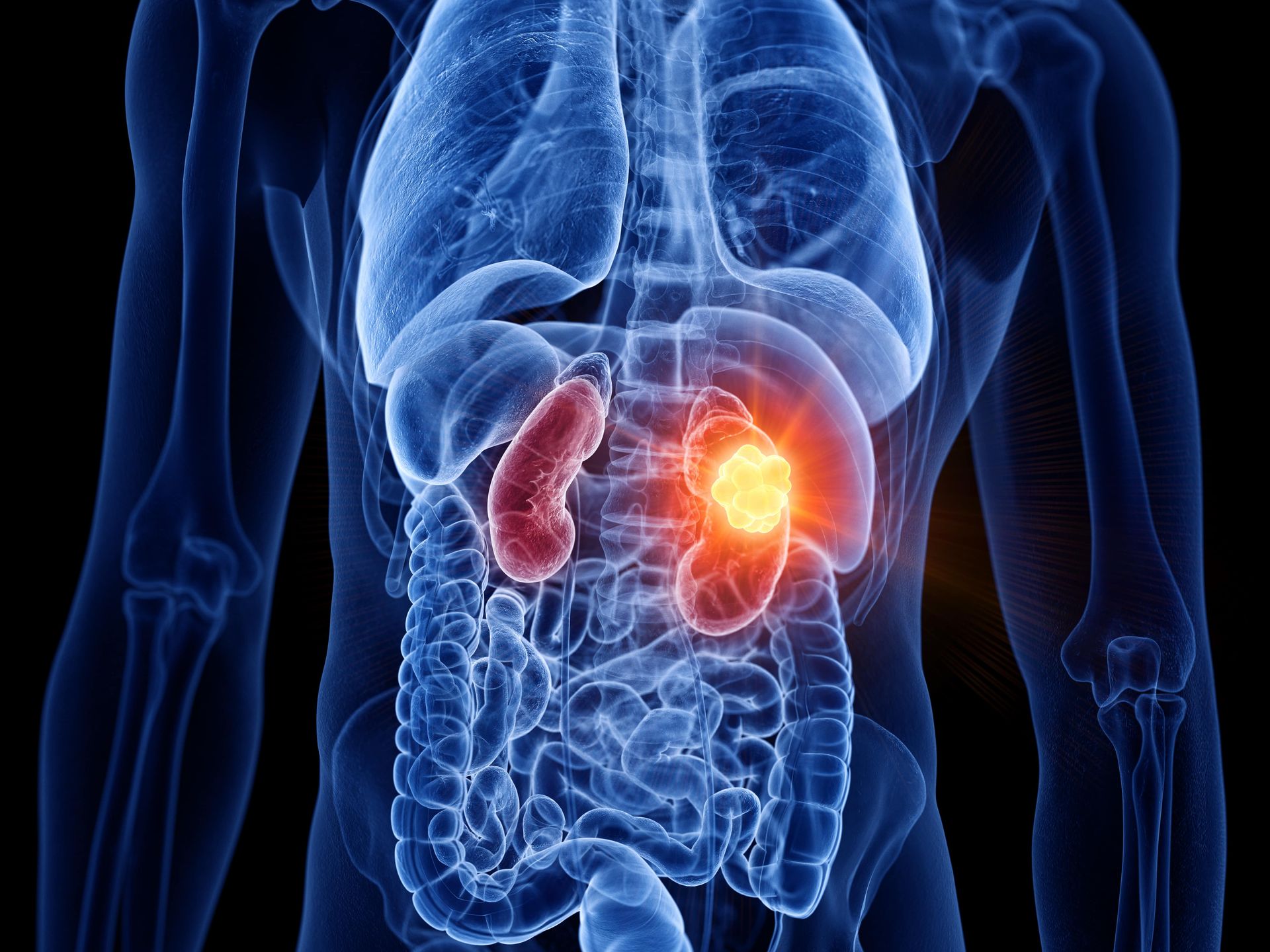
Por que os TKIs são indicados no câncer renal?
O tipo mais comum de câncer renal em adultos, o carcinoma de células renais (CCR), geralmente apresenta alterações genéticas que tornam certas vias de sinalização celular muito mais ativas — especialmente as que envolvem os fatores VEGF e PDGF, ligados à angiogênese. Como os TKIs
agem diretamente nesses caminhos, eles se tornaram parte fundamental do tratamento em casos avançados da doença.
Motivos que justificam essa indicação:
- O CCR é um tumor altamente vascularizado e dependente da formação de novos vasos para crescer.
- Vias celulares ativadas por mutações específicas tornam-se alvos diretos da terapia com TKIs.
- Estudos clínicos mostraram que o uso dos TKIs melhora o controle da doença e amplia a sobrevida livre de progressão.
Assim, os TKIs são utilizados tanto em
primeira linha de tratamento quanto em situações de progressão da doença ou quando a cirurgia não é uma opção viável.
Quais são os principais TKIs utilizados no câncer renal?
Existem hoje diversas opções de inibidores de tirosina-quinase aprovados para tratar o câncer renal, com mecanismos e perfis de tolerância distintos. A escolha do medicamento ideal é
individualizada, considerando o estágio da doença, o histórico do paciente e possíveis efeitos colaterais.
Alguns dos TKIs mais usados incluem:
Sunitinibe (Sutent®): atua em múltiplos alvos como VEGFR, PDGFR e c-Kit; foi um dos primeiros da classe usados no CCR.
Pazopanibe (Votrient®):
similar ao sunitinibe em eficácia, mas com perfil de toxicidade diferente.
Axitinibe (Inlyta®): indicado geralmente como segunda linha de tratamento.
Cabozantinibe (Cabometyx®): eficaz em pacientes com progressão da doença, atuando também em MET e AXL.
Lenvatinibe (Lenvima®): frequentemente utilizado em combinação com imunoterapia.
Todos esses medicamentos são de uso
oral, exigindo
acompanhamento contínuo para ajustes de dose e controle de efeitos adversos.
Quais são os principais benefícios dos TKIs no câncer renal?
O surgimento dos TKIs transformou a forma como tratamos o carcinoma de células renais metastático, oferecendo aos pacientes
mais tempo e qualidade de vida, mesmo em estágios avançados da doença.
Benefícios observados:
- Redução significativa do tamanho do tumor.
- Aumento da sobrevida livre de progressão.
- Alívio de sintomas relacionados a metástases.
- Possibilidade de tratamento ambulatorial, com comprimidos, sem necessidade de internação.
Estudos como o COMPARZ e o CABOSUN evidenciaram o impacto dos TKIs na melhora dos desfechos clínicos e no controle da progressão tumoral.
Quais são os efeitos colaterais mais comuns?
Assim como outras terapias oncológicas, os TKIs podem provocar efeitos adversos. O acompanhamento próximo é fundamental para garantir que o tratamento seja eficaz e bem tolerado. Sendo as reações mais frequentes:
- Cansaço persistente
- Pressão alta
- Diarreia
- Inflamações na mucosa da boca
- Alterações hepáticas
- Síndrome mão-pé (vermelhidão e dor em palmas e plantas)
Com
monitoramento adequado e ajustes de dose, a maioria desses efeitos pode ser controlada sem necessidade de interromper o tratamento.
O que muda quando os TKIs são combinados com imunoterapia?
Nos últimos anos, a combinação de TKIs com imunoterápicos, como os anticorpos anti-PD-1 e anti-PD-L1, trouxe resultados promissores, especialmente em pacientes com câncer renal metastático.
Combinações já aprovadas:
Pembrolizumabe + axitinibe
Nivolumabe + cabozantinibe
Lenvatinibe + pembrolizumabe
Essas associações demonstraram
aumento nas taxas de resposta, prolongamento da sobrevida global e controle mais duradouro da doença..
Quando os TKIs são indicados?
O uso dos TKIs pode ser recomendado em diferentes cenários clínicos, sempre com base em uma avaliação individualizada.
Principais indicações:
- Câncer renal metastático ou localmente avançado
- Doença que houve recidiva após cirurgia
- Falha de tratamentos anteriores
- Como tratamento inicial, isolado ou em combinação com imunoterapia
A decisão sobre qual TKI utilizar depende do
perfil molecular do tumor, da resposta anterior a outras terapias e da condição clínica
do paciente.
O que é importante avaliar antes de iniciar um TKI?
Antes de iniciar um tratamento com inibidor de tirosina-quinase, é essencial fazer uma avaliação completa do estado de saúde do paciente, identificando possíveis riscos e necessidades de monitoramento.
Pontos que devem ser analisados:
- Funções renal e hepática
- Risco cardiovascular, especialmente em pacientes hipertensos
- Interações medicamentosas
- Adesão ao uso contínuo do medicamento via oral
O planejamento do tratamento inclui
exames laboratoriais, avaliações clínicas periódicas e suporte para controle de efeitos colaterais.
Perguntas frequentes
O que são os inibidores de tirosina-quinase?
São medicamentos orais que bloqueiam enzimas chamadas tirosina-quinases, impedindo sinais que estimulam o crescimento e a sobrevivência de células tumorais. Eles ajudam a controlar o câncer ao dificultar a proliferação celular e a formação de novos vasos sanguíneos.
Para quais tipos de câncer os inibidores de tirosina-quinase são indicados?
Esses medicamentos são usados principalmente em cânceres como o de pulmão, rim, fígado, tireoide, leucemias e tumores gastrointestinais, especialmente quando há mutações genéticas que ativam as vias das tirosina-quinases.
Como funcionam os inibidores de tirosina-quinase no organismo?
Eles agem bloqueando os receptores celulares responsáveis por enviar sinais que promovem a divisão celular, a formação de vasos e a resistência à morte celular, contribuindo para desacelerar ou interromper a progressão do câncer.
Quais são os principais efeitos colaterais dos inibidores de tirosina-quinase?
Os efeitos variam, mas os mais comuns incluem fadiga, diarreia, hipertensão, alterações na função hepática, mucosite oral e síndrome mão-pé. O monitoramento contínuo é fundamental para ajustar o tratamento.
Os inibidores de tirosina-quinase curam o câncer?
Eles não são considerados curativos na maioria dos casos, mas são essenciais para controlar a doença, prolongar a sobrevida e melhorar a qualidade de vida, especialmente em cânceres avançados ou metastáticos.
Qual a diferença entre TKIs e imunoterapia?
TKIs atuam diretamente nas vias celulares tumorais, enquanto a imunoterapia estimula o sistema imunológico a atacar as células cancerígenas. Em alguns casos, os dois tratamentos são combinados para melhores resultados.
Quanto tempo dura o tratamento com inibidores de tirosina-quinase?
A duração varia conforme o tipo de câncer, a resposta ao tratamento e os efeitos colaterais. Em geral, o uso é contínuo enquanto houver benefício clínico e tolerância adequada.
É possível combinar inibidores de tirosina-quinase com outros tratamentos?
Sim. Combinações com imunoterapia, quimioterapia ou outras terapias-alvo são cada vez mais comuns, especialmente em tumores com características moleculares específicas. Essas combinações são definidas com base em estudos clínicos.
Como saber se meu câncer responde a TKIs?
Testes moleculares específicos, como análise de mutações em genes como EGFR, ALK ou VEGFR, ajudam a identificar se o tumor apresenta alvos para esse tipo de tratamento. O oncologista solicita esses exames quando indicados.
Quais são os inibidores de tirosina-quinase mais conhecidos?
Entre os mais utilizados estão o imatinibe, sunitinibe, erlotinibe, gefitinibe, axitinibe, pazopanibe, cabozantinibe e lenvatinibe. A escolha depende do tipo de tumor e do perfil do paciente.
Por que nem todos os pacientes com câncer podem usar inibidores de tirosina-quinase?
Porque seu uso depende da presença de mutações específicas ou da ativação de certas vias celulares. Se o tumor não tiver essas alterações, os TKIs não serão eficazes.
Quais exames são necessários antes de iniciar um TKI?
Geralmente são solicitados exames de sangue (função renal e hepática), eletrocardiograma e testes genéticos ou moleculares para confirmar a indicação do medicamento.
É necessário manter uma dieta específica durante o uso de TKIs?
Alguns alimentos e suplementos podem interferir na absorção dos TKIs ou aumentar seus efeitos colaterais. O médico pode orientar restrições como evitar toranja (grapefruit) e certos fitoterápicos.
Os TKIs continuam funcionando se o câncer voltar a crescer?
Nem sempre. Em alguns casos, o tumor desenvolve resistência ao medicamento, e o oncologista pode indicar troca por outro TKI ou combinação terapêutica mais eficaz.
Existe diferença entre os TKIs de primeira, segunda e terceira geração?
Sim. Eles evoluem em especificidade, potência e capacidade de superar mecanismos de resistência tumoral. A escolha depende do estágio da doença e da mutação presente.
O tratamento com TKIs pode ser interrompido temporariamente?
Sim, em alguns casos, como durante efeitos colaterais intensos ou outros tratamentos paralelos. A interrupção, no entanto, deve ser feita com acompanhamento médico rigoroso.
É possível desenvolver resistência aos TKIs com o tempo?
Sim. O tumor pode sofrer mutações adicionais que o tornam insensível ao medicamento inicial. Por isso, é comum trocar o TKI ou combiná-lo com outras terapias ao longo do tratamento.
Especialista em oncologia em São Paulo | Dr. Gustavo Schvartsman
Os inibidores de tirosina-quinase revolucionaram o tratamento do câncer renal ao oferecerem uma alternativa eficaz e direcionada para controlar a progressão tumoral. Seja como monoterapia ou em combinação com imunoterapia, esses medicamentos
representam esperança real para pacientes com carcinoma de células renais avançado. A escolha do tratamento ideal deve ser feita com base em avaliações clínicas precisas e acompanhamento especializado.
Se você busca por um oncologista com expertise e experiência, sou o Dr. Gustavo Schvartsman, especialista em oncologia clínica. Formado pela Escola Paulista de Medicina/Universidade Federal de São Paulo, me especializei no MD Anderson Cancer Center, adquirindo experiência internacional e aprofundando meu foco em imunoterapia. Hoje atuo no Hospital Israelita Albert Einstein, onde ofereço tratamentos personalizados e terapias de última geração.
Meu compromisso é garantir que cada paciente receba o melhor cuidado possível e as opções de tratamento mais adequadas para seu caso. Para mais informações, acesse o meu site ou clique aqui para agendar uma consulta.
Continue acompanhando a central educativa para acessar conteúdos importantes sobre saúde. Até o próximo artigo.