Melanoma com mutação BRAF Positivo: Entenda o que é
O melanoma é o tipo mais agressivo de câncer de pele, responsável pela maioria das mortes associadas à doença. Nos últimos anos, descobertas genéticas revolucionaram a forma de diagnosticar e tratar o melanoma, especialmente com a identificação da mutação no gene BRAF. Quando o tumor apresenta essa alteração, ele é chamado de melanoma BRAF positivo, e isso abre portas para estratégias terapêuticas personalizadas, que têm melhorado significativamente os resultados clínicos.
Neste artigo, você vai entender o que significa essa mutação, como ela impacta o desenvolvimento do melanoma e quais são os tratamentos mais modernos disponíveis.
Continue lendo
e aprenda mais sobre essa mutação.
O que é o melanoma BRAF positivo?
O melanoma BRAF positivo é um subtipo de melanoma caracterizado por uma mutação no gene BRAF, responsável pela
produção de uma proteína que regula o crescimento celular. Quando alterada, essa proteína permanece constantemente ativada, o que estimula a
divisão celular descontrolada e favorece o desenvolvimento do câncer.
Estudos mostram que entre
40% e 50% dos melanomas cutâneos apresentam essa mutação, sendo mais frequente em pacientes mais jovens e em tumores localizados em regiões menos expostas ao sol de forma crônica. A variante mais comum é a V600E, mas outras, como V600K, também podem estar presentes.
Assista ao vídeo:
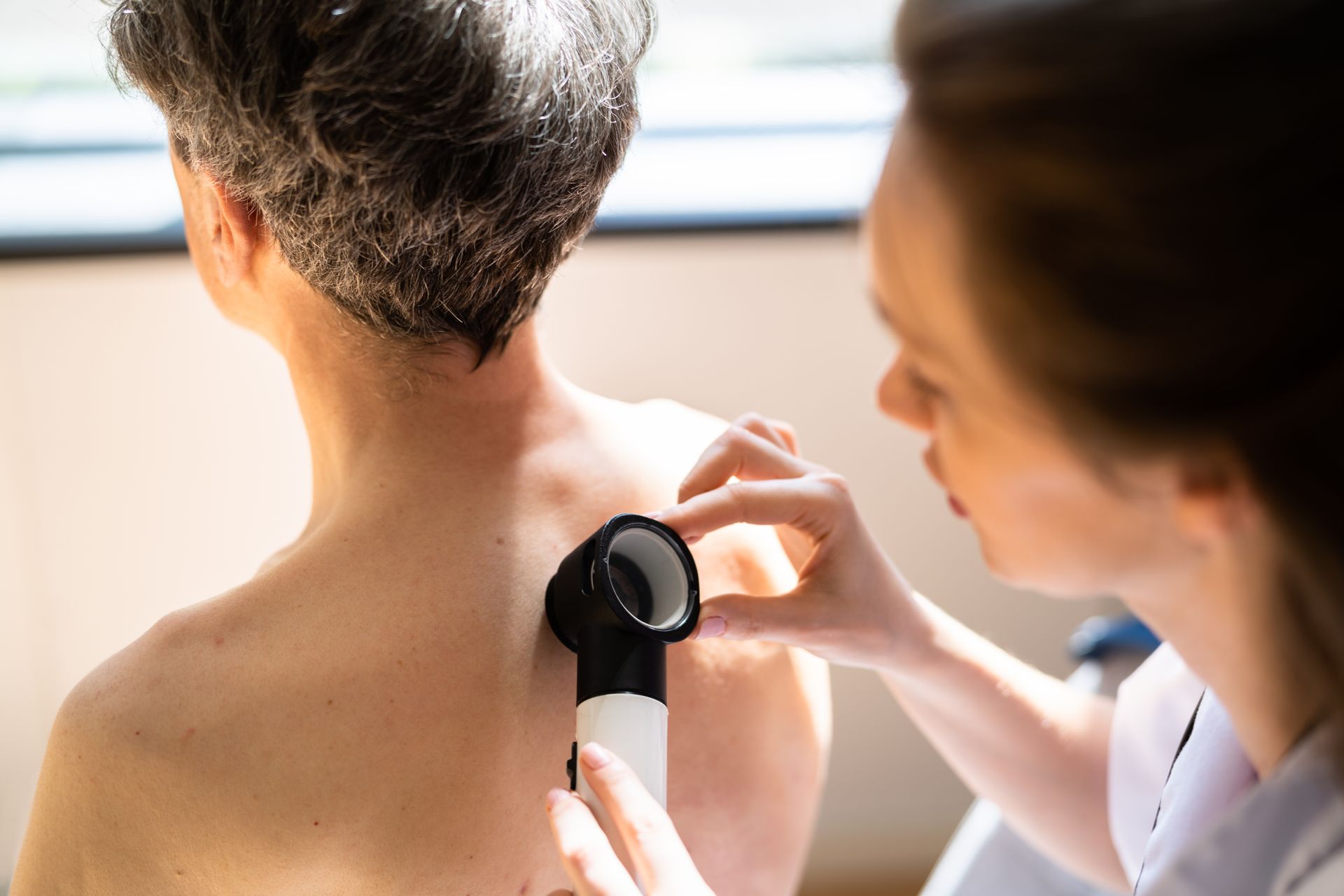
Como é feito o diagnóstico da mutação BRAF?
O diagnóstico é realizado a partir de uma
biópsia tumoral, seguida da
análise
do material coletado em laboratório. Além da avaliação histopatológica, são feitos exames genéticos para identificar a presença da mutação.
Principais métodos utilizados:
- PCR (Reação em Cadeia da Polimerase): detecta mutações específicas de forma rápida, geralmente as mais comuns.
- Sequenciamento genético (NGS – Next Generation Sequencing): permite avaliar várias alterações ao mesmo tempo, abrange as mutações menos frequentes.
- Imuno-histoquímica: utilizada em alguns casos como teste de triagem, mas restrito à variante V600E.
Esse processo é fundamental para definir a estratégia terapêutica mais eficaz.
Diferença entre melanoma BRAF positivo e negativo
Nem todos os melanomas apresentam mutações em BRAF. Essa distinção é essencial porque influencia diretamente no tratamento.
- BRAF positivo: possibilita o uso de terapias-alvo, além da imunoterapia, que bloqueiam especificamente a mutação.
- BRAF negativo: geralmente tratado apenas com imunoterapia, conforme o estágio da doença e características do paciente.
Tratamentos disponíveis para o melanoma BRAF positivo
Terapias-alvo
A principal inovação foi a criação de medicamentos que atuam diretamente na proteína mutada,
interrompendo o crescimento desordenado
das células tumorais.
Exemplos:
Inibidores de BRAF: encorafenib (Braftovi®) e dabrafenibe (Tafinlar®).
Inibidores de MEK: binimetinib (Mektovi®) e cobimetinibe (Cotellic®), usados em combinação com inibidores de BRAF.
O
uso combinado
dessas drogas é o padrão atual, aumentando a eficácia e diminuindo o risco de resistência. Estudos clínicos mostram respostas em até 70% dos pacientes.
Imunoterapia
Medicamentos como nivolumabe e pembrolizumabe (anti-PD-1) podem ser usados isoladamente ou junto
das terapias-alvo, estimulando o sistema imunológico a reconhecer e combater o tumor.
Entenda mais sobre a imunoterapia no tratamento do Melanoma. Assista:
Imunoterapia vs. Terapia Alvo: Como Eu Escolho?
Para pacientes com mutação no BRAF, a imunoterapia ainda pode trazer benefícios de longo prazo melhores que a terapia alvo-dirigida contra BRAF, mas costuma ser de forma combinada (ipilimumabe + nivolumabe, por exemplo).
Porém, como as respostas à terapia alvo são muito rápidas, sua principal indicação como primeira opção de tratamento é para pacientes com alto volume de doença, com sintomas importantes ou com metástases cerebrais grandes, que exigem o uso de corticosteroides, que podem atrapalhar a eficácia da imunoterapia.
Quimioterapia
Embora menos utilizada atualmente, ainda pode ser indicada em casos nos quais não há resposta ou acesso a terapias mais modernas.
Benefícios da terapia personalizada
O tratamento do melanoma BRAF positivo trouxe mudanças importantes na prática clínica:
- Resposta mais rápida, no qual muitos pacientes apresentam redução do tumor em poucas semanas.
- Maior sobrevida global com resultados superiores aos obtidos com quimioterapia isolada.
- Tratamento direcionado: ação seletiva sobre células com mutação, preservando tecidos saudáveis.
Importância do acompanhamento contínuo
O melanoma BRAF positivo exige
monitoramento regular, com exames de imagem e avaliações clínicas periódicas para acompanhar a resposta ao tratamento e identificar possíveis sinais de progressão.
O acompanhamento multidisciplinar, envolvendo
oncologistas, dermatologistas, nutricionistas e psicólogos, também é essencial para manter a qualidade de vida e o bem-estar durante toda a jornada terapêutica.
Perguntas frequentes
O que significa ter um melanoma BRAF positivo?
O melanoma BRAF positivo ocorre quando o tumor apresenta uma mutação no gene BRAF, responsável por regular o crescimento celular. Essa alteração mantém a proteína ativada, levando à multiplicação descontrolada das células cancerígenas.
Qual a diferença entre melanoma BRAF positivo e negativo?
O melanoma BRAF positivo pode ser tratado com terapias-alvo específicas, enquanto o melanoma BRAF negativo é geralmente tratado com imunoterapia ou quimioterapia. Essa distinção é essencial para definir a estratégia terapêutica mais eficaz.
Qual é a mutação mais comum no melanoma BRAF positivo?
A mutação mais frequente é a V600E, encontrada na maioria dos casos. Outra variante possível é a V600K, que também pode influenciar a escolha do tratamento.
Como é feito o diagnóstico do melanoma BRAF positivo?
O diagnóstico é realizado por meio de uma biópsia tumoral seguida de testes genéticos, como PCR ou sequenciamento de nova geração (NGS), que identificam a presença da mutação no gene BRAF.
Quais são os principais tratamentos para melanoma BRAF positivo?
Os tratamentos incluem terapias-alvo (inibidores de BRAF e MEK), imunoterapia (como anti-PD-1) e, em alguns casos, quimioterapia. A combinação de inibidores de BRAF e MEK é o padrão atual, com taxas de resposta mais elevadas.
O melanoma BRAF positivo pode voltar após o tratamento?
Infelizmente, sim. Muitos pacientes desenvolvem resistência adquirida aos medicamentos após meses ou anos de uso. Por isso, o acompanhamento clínico e exames regulares são fundamentais.
Quais são os efeitos colaterais do tratamento do melanoma BRAF positivo?
Os efeitos mais comuns incluem febre, fadiga, alterações de pele e, em alguns casos, problemas cardiovasculares. Com monitoramento adequado, a maioria pode ser controlada.
Todo paciente com melanoma precisa testar a mutação BRAF?
Sim. A análise genética é recomendada em todos os casos de melanoma avançado ou metastático, pois define a elegibilidade para terapias-alvo e ajuda na escolha do melhor tratamento.
O melanoma BRAF positivo tem cura?
Quando diagnosticado em estágios iniciais e tratado corretamente, pode haver altas taxas de controle e até cura. Em casos avançados, as terapias modernas aumentam significativamente a sobrevida e a qualidade de vida, mas exigem acompanhamento contínuo.
Por que nem todos os melanomas com mutação BRAF respondem da mesma forma ao tratamento?
Apesar da presença da mutação, fatores como outras alterações genéticas do tumor, o microambiente tumoral e a condição clínica do paciente podem influenciar na resposta à terapia.
Como o corpo desenvolve resistência aos inibidores de BRAF e MEK?
Com o tempo, as células tumorais podem ativar outras vias de crescimento celular, contornando o bloqueio do medicamento e voltando a crescer, o que exige ajuste no tratamento.
Existe diferença de prognóstico entre os subtipos de mutação BRAF (V600E e V600K)?
Sim. A mutação V600E é mais comum e geralmente responde melhor ao tratamento com terapias-alvo do que a V600K, embora ambas possam ser tratadas com combinações de BRAF e MEK.
Especialista em oncologia em São Paulo | Dr. Gustavo Schvartsman
O melanoma BRAF positivo representa um subtipo agressivo, mas que hoje conta com terapias inovadoras que mudaram o cenário do tratamento oncológico. O diagnóstico da mutação é fundamental para orientar o tratamento e oferecer opções mais eficazes e personalizadas. Embora ainda haja desafios,
os avanços da oncologia trazem novas perspectivas de sobrevida e qualidade de vida para os pacientes.
Você já conhecia essa mutação no melanoma?
Se você busca por um oncologista com expertise e experiência, sou o Dr. Gustavo Schvartsman, especialista em oncologia clínica. Formado pela Escola Paulista de Medicina/Universidade Federal de São Paulo, me especializei no MD Anderson Cancer Center, adquirindo experiência internacional e aprofundando meu foco em imunoterapia. Hoje atuo no Hospital Israelita Albert Einstein, onde ofereço tratamentos personalizados e terapias de última geração. Meu compromisso é garantir que cada paciente receba o melhor cuidado possível e as opções de tratamento mais adequadas para seu caso. Para mais informações, acesse o meu site ou clique aqui para agendar uma consulta.
Continue acompanhando a central educativa para acessar conteúdos importantes sobre saúde. Até o próximo artigo.